浙江大学转化医学院的一间实验室里,科学家正尝试用近红外激光照射乳腺癌小鼠。3分钟后,等候在肿瘤部位的“药匣子”打开了,抗肿瘤药物快速均匀地渗透到肿瘤深层组织。4小时后,肿瘤细胞陆续凋亡……
通过医学、化工、光学、临床等多学科协作,浙江大学医学院附属第二医院/转化医学研究院的周民团队构建出一种“抗癌纳米材料多级载药系统”,肿瘤药物“暗度陈仓”向肿瘤组织深层递送,明显抑制恶性肿瘤的转移,研究成果发表在Advanced Functional Materials(《先进功能材料》)上,并被编辑部遴选为纸质版Front Cover封面文章。

图:AFM杂志纸质版封面预览版。纳米聚合球在近红外激光激发下在肿瘤内部可以释放出阿霉素,并可将阿霉素输送到深层组织
▍抗癌药难题:跑太快,跑不远
当前,一些被证明对肿瘤确有效果的药物在临床上有较大局限。其中一项关键局限在于:药物“跑太快”和“跑不远”。周民团队最新设计的多级载药系统,就是针对这一临床需求研发的。他们让抗癌药物“慢”下来,并能渗透到常规抗癌药进入不了的肿瘤深层组织。
“跑太快”指的是药物的代谢速度快。“一般情况下,不到24小时,药物就会就被代谢出体外,药效发挥的时间很短或者真正跑到肿瘤里去的药物很少,所以需要持续用药。”周民介绍,抗肿瘤药物通常对机体的正常细胞也有杀伤力。这些药物经过静脉注射后先到达心脏,然后通过动脉到达身体各个脏器,最终在肝脏中“降解”,或者通过肾脏代谢掉。这也是为什么过量摄入药物有引起肝损伤或者肾损伤的风险。
在这项研究中,周民团队使用了一种广谱型抗癌药阿霉素。小分子阿霉素通过破坏肿瘤细胞的DNA起效,但同时对心肌细胞也有很强损伤。假如小鼠注射阿霉素,24小时后通过荧光影像观察,你会看到有较多的药物聚集在心脏部位。在药效与安全性的权衡与纠结中,临床医生们期待着能出现两全的方案。

图:在超高放大倍数的透射电子显微镜下,可以观察到药物中含有大量的纳米聚合球。其中每一个聚合球(右上角放大图)中包含有超小尺寸的纳米点(黑色点)和阿霉素(球中灰色部分)
周民团队对阿霉素进行了改造,让多个阿霉素小分子“搭乘”纳米颗粒载体,形成一个聚合球。“通过组装,我们能对这个聚合球进行表面修饰操作,从而调节它在机体内的‘行为’。”论文第一作者、实验技术员马飞说,“药物+载体”是一种常见的药物设计方案,通过这个设计,药物的“个头”变大了,一定程度延长了药物在机体内停留的时间。“这样,药物就有足够的时间到达肿瘤部位”。这还不够,周民团队设计的这种药物递送系统,这是一个光控的“药匣子”,能有效解决传统抗肿瘤药物“跑不开”的问题。
▍设置“开关”
药物在肿瘤组织内部的输送过程中,面临着非常复杂的肿瘤微环境和多重生物屏障。“跑不开”是抗癌药物很难缠的一道障碍。众所周知,实体肿瘤细胞与正常细胞相比,生长速度可谓疯狂,肿瘤细胞周围分布着丰富的血管,以给肿瘤细胞提供疯长的营养。“但由于长得太快,血管生长跟不上肿瘤细胞分裂的速度,导致肿瘤细胞深层没有血管分布。”周民说,传统的抗癌药物分子要通过血管才能到达肿瘤细胞,血管到达不了的地方,也是药物到达不了的地方。这是是当前肿瘤药物研发的重大挑战之一。
周民团队设计的抗癌药物聚合球,是一个具有光活性的纳米团簇。只有在特定波长的光的激发下,这些搭载在“球”上的抗癌分子才会释放扩散。
直径约40纳米的纳米团簇通过静脉注射到乳腺癌小鼠体内,药物团簇通过血液系统向肿瘤蓄积,24小时后,它们只等体外一束激光的“命令”。课题组选用的是800纳米波长的近红外光,这种光线的穿透力很强,最多能穿透5厘米左右的生物组织。在光的“命令”下,纳米球“解体”为超小尺寸的纳米点和抗癌分子,在肿瘤组织内部快速渗透。“超小尺寸的纳米点和药物具有较高的渗透能力,因此药物能够顺利渗透到肿瘤深层组织。”马飞说。
▍药物“暗度陈仓”

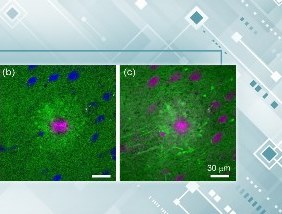
图:肿瘤组织的免疫荧光染色结果表明,纳米聚合球中的阿霉素(绿色荧光)不但可以在肿瘤内血管(红色荧光)周围有分布,而且在近红外激光激发下,可以在肿瘤深层组织具有非常好的分散性,表明阿霉素可以高效的“跑到“深层肿瘤组织
3分钟后,等候在肿瘤部位的“药匣子”打开了,抗肿瘤药物快速均匀地渗透到肿瘤深层组织。4小时后,肿瘤细胞陆续凋亡,肿瘤开始逐渐变小。
进一步实验表明,该多级载药系统不但可以高效地摧毁肿瘤细胞,同时还可以显著抑制肿瘤干细胞的生长。可以在消除原位肿瘤的同时,抑制肿瘤转移的发生。由于具有较好的肿瘤集聚能力,该系统可以显著降低抗肿瘤药物的心脏和系统毒性,具有较高的临床转化前景。
需要指出的是,尽管该方法的治疗效果让人鼓舞,但是目前实验结果仍仅仅在小动物水平得到了验证。“想要应用于临床,仍需要大量的试验。不过可以肯定的是,我们找到了能够提升肿瘤治疗效率和治疗安全性的新方法,这是一个正确的研究方向。”周民认为,该项研究工作的研发为未来的精准医疗和个性化药物发展提供了新的思路,为肿瘤的精准治疗提供了一种新的策略。
论文审稿人认为:这项研究一个新颖的纳米系统,可以优先在肿瘤聚集并可以增强药物在肿瘤的渗透性,“这个设计非常吸引人,可能更具有较高的治疗价值和转化前景。”
浙江大学医学院附属第二医院田梅和张宏教授、芬兰赫尔辛基大学Helder Santos教授是该研究的主要合作者。该研究同时获得科技部重点研发计划、国家自然科学基金、国家青年千人计划、恶性肿瘤预警与干预教育部重点实验室及现代光学仪器国家重点实验室等的支持。
论文链接:
Jianfeng Ji, et al, "Light‐Activatable Assembled Nanoparticles to Improve Tumor Penetration and Eradicate Metastasis in Triple Negative Breast Cancer," Advanced Functional Materials, DOI: 10.1002/adfm.201801738
课题组合影:

周民研究员:“国家青年千人计划”和浙江大学“百人计划”入选者,并担任教育部恶性肿瘤预警与干预重点实验室副主任。自2016年回国以来,周民研究员及其带领的研究团队充分利用我校学科门类齐全、学科结构层次丰富、交叉学科平台集聚等学科生态多样化的优势,主要围绕“分子影像和纳米医学”在癌症诊断及治疗中的应用这一国际研究热点,致力于新型纳米药物的研发,取得了一系列创新性并具有较高临床转化前景的重要研究成果,并获得浙江大学2017年度十大学术进展提名奖。
(本文来源:浙江大学新闻网;)如若转载,请注明e科网。
如果你有好文章想发表or科研成果想展示推广,可以联系我们或免费注册拥有自己的主页
- 浙江大学
- 周民
- 抗癌药物


 我要投稿
我要投稿